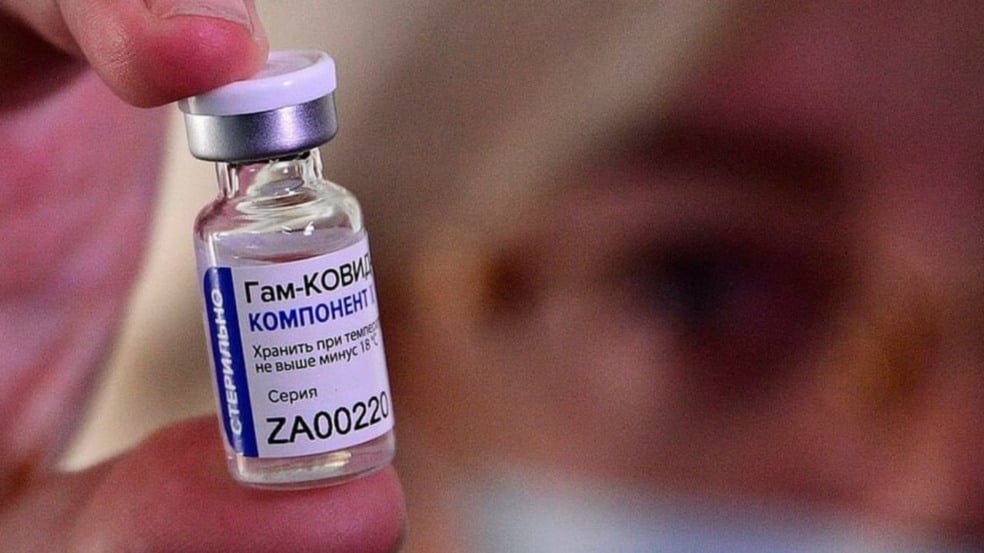
Nesta quarta-feira (3), o Ministério da Saúde anunciou que irá se reunir com representantes do instituto russo Gamaleya, fabricante da vacina Sputnik V, e com o laboratório indiano Bharat Biotech, fornecedor da vacina Covaxin, para negociar a compra de mais de 30 milhões de doses de imunizantes contra a Covid-19. A reunião deve acontecer nesta sexta-feira (5).
“A decisão de avançar as negociações ocorre após a Agência Nacional de Vigilância Sanitária (Anvisa) autorizar o novo protocolo com simplificação do processo de concessão de uso emergencial e temporário de vacinas, dispensando a realização de estudos clínicos de fase III. A expectativa da pasta é ter acesso aos imunizantes ainda em fevereiro”, afirmou o Ministério da Saúde.
De acordo com a decisão da Anvisa, agora não é mais necessário os estudos da fase três de testes das vacinas no Brasil para a aprovação do uso emergencial no país. Nestes casos, a agência previu um prazo de análise do pedido de até 30 dias.
Com condições
Segundo o gerente de medicamentos da empresa, Gustavo Mendes, a Anvisa orienta que o estudo da terceira fase de testes seja “preferencialmente” realizado também no Brasil. De acordo com Mendes, quando a empresa fornecedora das vacinas optar por não conduzir os testes por aqui, deve atender outros critérios:
- Acompanhamento dos participantes para a avaliação de eficácia e segurança dos participantes do estudo por pelo menos 1 ano;
- Garantia de acesso aos dados gerados em sua totalidade;
- Demonstração que estudos pré-clínicos e clínicos foram conduzidos conforme as diretrizes aceitas nacional e internacionalmente.
Além disso, para o caso de estudos não conduzidos no Brasil, a Anvisa coloca como condição para a empresa fornecedora:
- Comprometer-se a concluir o desenvolvimento da vacina em todos os aspectos, apresentar e discutir os resultados com a Anvisa;
- Prazo de análise para vacinas sem estudo desenvolvido aqui no Brasil será de até 30 dias.
Gustavo Mendes ainda disse que é importante destacar que a empresa que não aplicou testes clínicos no Brasil deve se comprometer a solicitar o registro sanitário no país.
Outras vacinas
A decisão da Anvisa deve facilitar a importação de imunizantes como a Sputnik V. Esta teve os resultados da fase 3 publicados em revistas científicas, mas que não testaram no Brasil.
A princípio, a Anvisa exigia que as empresas conduzissem a terceira fase de estudos clínicos das vacinas no Brasil. Só assim poderiam solicitar o uso emergencial no país. Dessa forma, quatro empresas realizaram os testes no Brasil: a Johnson & Johnson, a Pfizer, a Oxford e a Sinovac.
Até o momento, apenas as vacinas da Oxford e da Sinovac passaram pela aprovação para o uso emergencial, e a vacinação no Brasil já começou com elas.
Acordo da União Química com Gamaleya
A União Química é a empresa que tem um acordo de transferência para produzir a vacina Sputnik V no Brasil. Eles solicitaram à Anvisa a autorização para a realização dos testes no Brasil. Nesta terça-feira (2), quando uma revista científica publicou os resultados dos testes, a agência informou que a eficácia do imunizante, de 91,6%, era “boa notícia”. No entanto, listou pontos pendentes no pedido.
Assim, a Anvisa afirmou ao G1 que “existe um pedido da empresa de estudo de fase 3 em aberto na Anvisa. Este pedido está com pendências apontadas pela Anvisa e que estão sendo providenciadas pela empresa”.